

向下滾動
海森生物宣布新型第三代PCSK9抑制劑Lerodalcibep臨床試驗申請獲得國家藥品監督管理局CDE受理
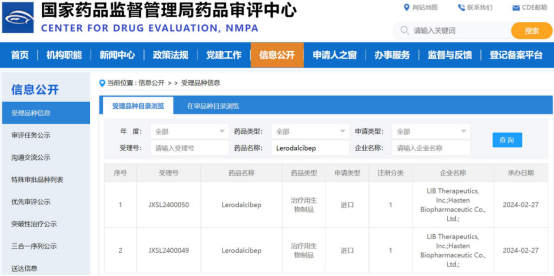
2024年2月27日,海森生物醫藥有限公司(以下簡稱:海森生物)宣布新型第三代PCSK9抑制劑Lerodalcibep臨床試驗申請(IND)已獲得中國國家藥品監督管理局(NMPA)藥品審評中心(CDE)受理,用于治療高膽固醇血癥患者,進一步降低低密度脂蛋白膽固醇(LDL-C)的水平。
海森生物首席執行官夏少斐先生表示:“獲得Lerodalcibep在大中華區開發和商業化的獨家專有權后,我們的項目團隊立刻準備其在華臨床試驗的申請資料、迅速遞交并獲得了受理。這彰顯了‘海森速度’和公司積極推動創新藥在中國臨床研究進程的決心,同時也進一步夯實了海森生物全產業鏈發展、多管線齊頭并進的戰略路徑,更好地助力‘健康中國2030’戰略目標和‘十四五’國民健康規劃早日實現。”
海森生物副總裁、醫學部負責人劉蒙博士表示:“國外III期臨床試驗數據證實新型第三代PCSK9抑制劑Lerodalcibep每月皮下一針給藥可持續降低LDL-C,同時現有穩定性實驗結果表明其在室溫下具備更優秀的穩定性。我們將積極配合監管機構對Lerodalcibep的審評,推動臨床試驗進程,讓Lerodalcibep盡快為動脈粥樣硬化性心血管疾病(ASCVD)患者和/或ASCVD極高危或高危人群提供更多的治療選擇。”
Lerodalcibep臨床試驗申請獲NMPA受理是基于LIB Therapeutics, Inc.所提供的完整的美國和歐洲已獲得的CMC、非臨床及臨床研究數據以及海森生物擬在國內開展的臨床開發計劃。
新型第三代PCSK9抑制劑Lerodalcibep是海森生物引入的首個在研創新藥,與現有7款經典原研藥協同加強了其在慢性病和急重癥領域的產品布局。未來,海森生物將與更多業界合作伙伴攜手,為滿足中國患者不斷增長的、對高品質醫療健康解決方案的需求而不懈努力。
注:本文涉及研究中的藥品尚未在中國獲批,海森生物不推薦任何未被批準的藥品使用。
關于海森生物
海森生物醫藥有限公司(簡稱:海森生物)是一家成立于2020年的創新型生物醫藥企業,業務聚焦于慢性病和急重癥領域。秉承誠信、敏捷、創新和主人翁精神的核心價值觀,海森生物致力于成為中國健康行業引領者,攜手政府相關機構、醫療衛生專業人士及業界合作伙伴,提供優質產品和解決方案,造福更多患者,共創社會健康價值。
更多關于海森生物的信息,請瀏覽www.ahbcy.cn。
關注我們的領英賬號(Hasten)。
關于Lerodalcibep
Lerodalcibep融合蛋白是第三代新型長效PCSK9抑制劑,由LIB Therapeutics開發,對解決當前臨床降脂治療未被滿足的治療需求有很大的潛力,目前用于降低LDL-C適應癥的注冊III期關鍵研究已經全部結束。與傳統PCSK9抑制劑單克隆抗體相比,Lerodalcibep每月僅需注射一針,且注射體積更少(1.2ml),可以幫助減少注射部位不良反應和免疫原性。此外,Lerodalcibep在室溫下更穩定,這些都將為臨床應用提供更大的便利性。預計Lerodalcibep的獲批將為醫生和患者帶來更具臨床價值的治療新選擇,助力更多高脂血癥患者實現血脂控制達標。Lerodalcibep針對心血管疾病(CVD)患者或CVD極高風險患者的最后兩項III期試驗,LIBerate-CVD和LIBerate-HR已于2023年11月宣布完成。按照計劃,LIB Therapeutics將于在2024年上半年向美國食品藥品監督管理局(FDA)提交生物制品許可申請,并向歐洲藥品管理局(EMA)提交上市申請。
關于LIBerate三期臨床試驗
LIBerate是一項大型、綜合性全球III期臨床試驗項目,其注冊計劃由四項關鍵III期臨床研究組成,在2,387例心血管疾病(CVD)、CVD極高和高風險、雜合子家族性高膽固醇血癥(HeFH)及純合子FH(HoFH)患者中開展了Lerodalcibep的臨床研究。已公布的LIBerate-HoFH(LIB-003-003,n=65)和LIBerate-HeFH(LIB-003-004,n=479)的III期研究均已完成并達到了主要終點。整個III期研究項目中超過2,200名患者繼續參加為期72周的開放標簽擴展研究。
前瞻性聲明
本新聞稿所發布的信息中可能會包含某些前瞻性表述。這些表述本質上具有相當風險和不確定性。在使用"預期"、"相信"、"預測"、"期望"、"打算"及其他類似詞語進行表述時,凡與本公司有關的,目的均是要指明其屬前瞻性表述。這些前瞻性表述是基于本公司管理層在做出表述時對未來事務的現有看法、假設、期望、估計、預測和理解。這些表述并非對未來發展的保證,會受到風險、不確定性及其他因素的影響,有些超出本公司的控制范圍,且難以預測。因此,受我們的業務、公司的競爭環境以及中國政治、經濟、法律和社會情況的未來變化及發展的影響,實際結果可能會與前瞻性表述所含資料有較大差別。
審批號:NP-OT-2024-02-22
參考文獻:
- Laufs U, Blüher M, Isermann B. Third generation PCSK9-Inhibitors. Eur Heart J. 2023 Aug 28:ehad566. doi: 10.1093/eurheartj/ehad566. Epub ahead of print.
- Raal F, Fourie N, Scott R, Blom D, De Vries Basson M, Kayikcioglu M, Caldwell K, Kallend D, Stein E; LIBerate-HeFH Investigators. Long-term efficacy and safety of lerodalcibep in heterozygous familial hypercholesterolaemia: the LIBerate-HeFH trial. Eur Heart J. 2023 Aug 28:ehad596. doi: 10.1093/eurheartj/ehad596. Epub ahead of print.




